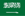1. Dissociação direta e adsorção de moléculas de água
Em locais metálicos insaturados de óxidos metálicos ou óxidos semicondutores (como Ti4+, Fe3+), as moléculas de água primeiro são adsorvidas na forma molecular, seguida pela clivagem da ligação O-H, resultando em pontes ou grupos hidroxila terminais (M-OH) e átomos de hidrogênio na superfície. A força motriz termodinâmica deste processo vem da forte acidez de Lewis dos íons metálicos, tornando as moléculas de água fáceis de dissociar. Tanto os experimentos quanto os cálculos DFT indicam que as superfícies cobertas com baixo teor de oxigênio tendem a dissociar e adsorver, enquanto as superfícies cobertas com alto teor de oxigênio tendem a adsorver moléculas.
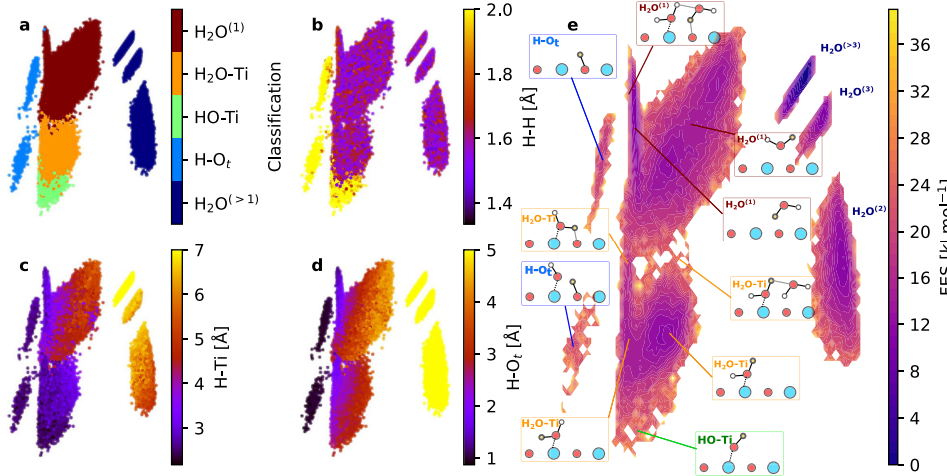
2. Geração de hidroxila mediada por vacância de oxigênio (VO)
As vagas de oxigênio na superfície fornecem elétrons, tornando as moléculas de água adsorvidas mais propensas à dissociação. Depois que as moléculas de água são adsorvidas na vaga, dois grupos hidroxila são gerados, um dos quais preenche a vaga e o outro fica pendurado no metal adjacente. Este mecanismo explica o fenômeno do aumento significativo na densidade da hidroxila sob condições redutoras ou de alta temperatura e está intimamente relacionado a mudanças no número de coordenação dos íons metálicos.
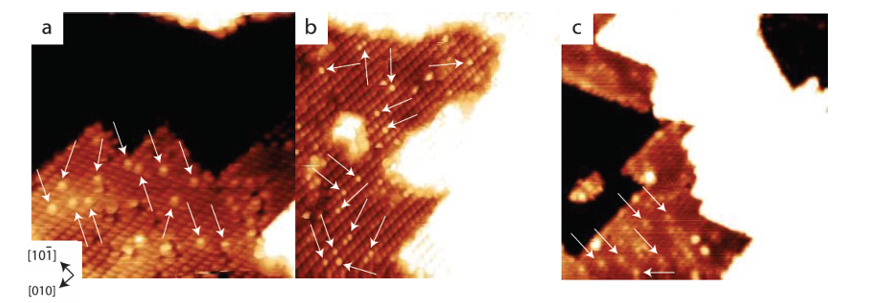
3. Estouro de átomo de hidrogênio ou hidrogênio
Na interface metal/óxido, o H2 se dissocia no metal para formar H ⁺/H ⁻, que então migra para a superfície do óxido metálico através do transbordamento de hidrogênio e forma grupos hidroxila com o oxigênio da superfície. Este processo foi observado diretamente em sistemas catalíticos, como a oxidação de CO em baixa temperatura, e o transbordamento de hidrogênio aumentou significativamente a taxa de geração de grupos hidroxila na superfície.
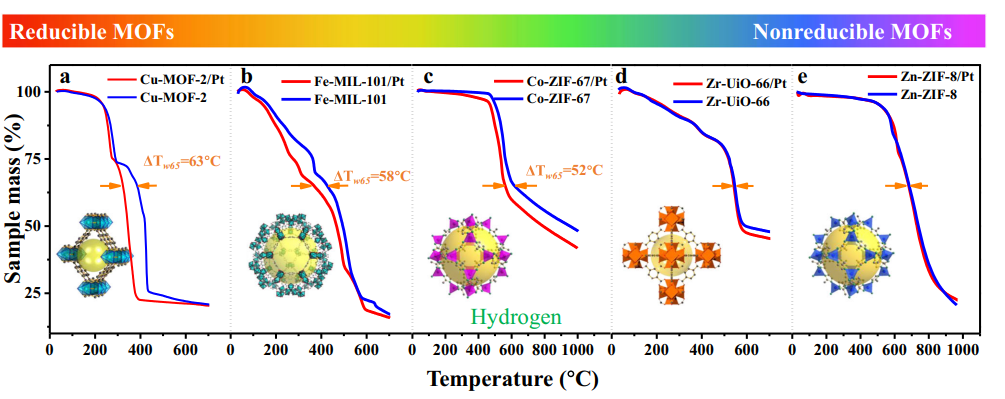
4. Formação de hidroxila induzida por fotocatalítico/UV
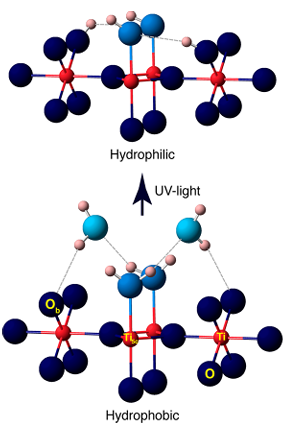
A luz UV excita semicondutores como o TiO2 para gerar pares de buracos de elétrons, que capturam átomos de oxigênio da superfície para formar O ⁻, e então reagem com moléculas de água adsorvidas ou grupos hidroxila para gerar OH ⁻ de superfície, acompanhado pela produção de radicais hidroxila (· OH). Experimentos mostraram que a irradiação UV gera vagas adicionais de oxigênio na superfície do TiO2, que reagem ainda mais com a água para gerar mais grupos hidroxila, levando à superhidrofilicidade fotoinduzida.
5.Formação de grupos hidroxila na superfície do óxido de alumínio
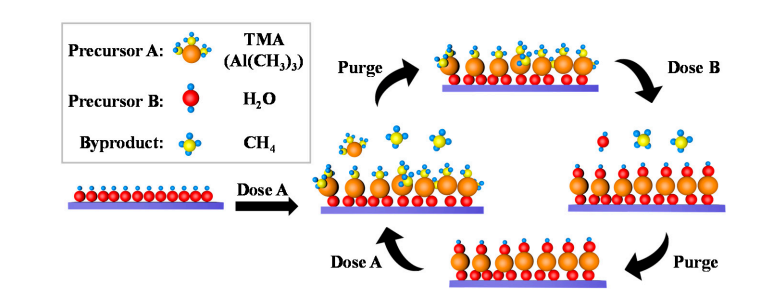
Uma pequena quantidade de grupos hidroxila existe naturalmente na superfície do óxido de alumínio, e as moléculas de água se dissociam e adsorvem nesses grupos hidroxila, produzindo novo Al-OH. Durante a deposição da camada atômica (ALD), o TMA (trimetilalumínio) sofre troca de coordenação com grupos hidroxila superficiais para formar ligações Al-O-Al e liberar metano; Posteriormente, o pulso de água reage novamente com ligações Al-O para regenerar grupos hidroxila superficiais, alcançando a regeneração cíclica de grupos hidroxila.
6. Reconstrução de superfície - A migração de metal leva à agregação de hidroxila
Na superfície do cristal de alumina ou óxido de titânio, íons metálicos locais (como Al3+) migram para vacâncias superficiais sob alta temperatura ou alto potencial hidroquímico, formando aglomerados hidroxila do tipo Al (OH) 3 ou Ti (OH) 3. Essa reconstrução é acompanhada por distorção da rede, o que torna mais favorável a adsorção de grupos hidroxila nas moléculas de água adjacentes, formando uma camada base hidroxila de alta densidade.
7. O mecanismo de hidrólise de grupos hidroxila na superfície do silício
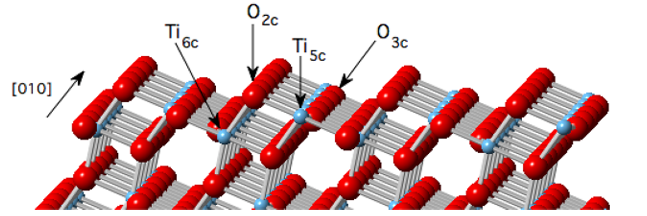
Na ligação da ponte Si-O-Si, as moléculas de água se combinam com a ligação silício-oxigênio por meio da transferência sinérgica de prótons e elétrons, formando grupos Si-OH. Este processo é particularmente importante na corrosão sob tensão na ponta da trinca e na hidrólise superficial do vidro, e o aumento da vibração de tração do Si-OH foi observado diretamente por espectroscopia experimental no infravermelho.
SAT NANO é o melhor fornecedor de nano pó e micro partículas na China, podemos oferecer pó de nanotubos de carbono, como
MWCNT-COOH,
MWCNT-OH, se você tiver alguma dúvida, não hesite em nos contatar em sales03@satnano.com