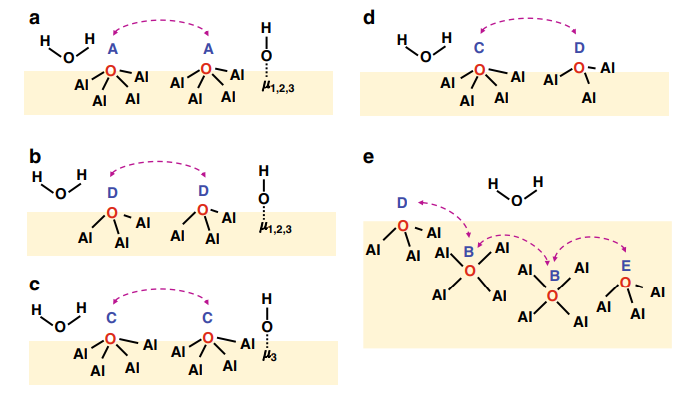
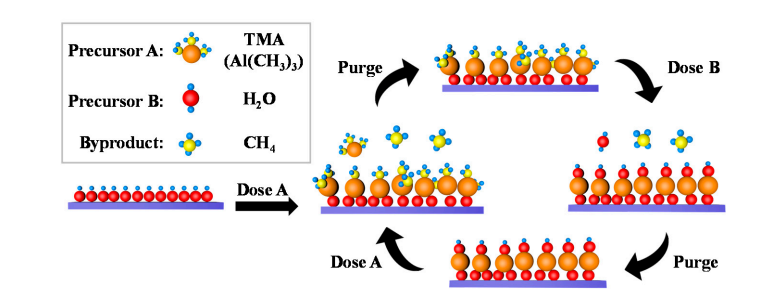
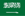- Lar
- Sobre nós
- Produtos
- Nanopartícula Metálica
- Nanopartícula de Prata
- Nanopartícula de ouro
- nanopartícula de cobre
- Nanopartícula de Cromo
- Nanopartícula de Titânio
- Nanopartícula de Ferro
- Nanopartícula de Zinco
- Nanopartícula de cobalto
- Nanopartícula de Boro
- Nanopartícula de Níquel
- Nanopartícula de Estanho
- Nanopartícula de tungstênio
- Nanopartícula de Nióbio
- Nanopartícula de molibdênio
- Nanopartícula de Alumínio
- Nanopartícula de Silício
- partícula de zircônio
- Pó de metal precioso
- Nanopartícula de Liga Metálica
- Dispersão e coloidal
- Nanopartícula de Óxido Metálico
- Nanopartícula de Óxido de Cobre
- Nanopartícula de Dióxido de Titânio
- Nanopartícula de Óxido de Zinco
- Nanopartícula de Dióxido de Manganês
- Nanopartícula de dióxido de estanho
- Nanopartícula de Óxido de Bismuto
- Nanopartícula de óxido de níquel
- Nanopartícula ITO
- Nanopartícula de Óxido de Magnésio
- Nanopartícula de óxido de cobalto
- Nanopartícula de óxido de ferro
- Nanopartícula de dióxido de zircônio
- Nanopartícula ATO
- Nanopartícula de Sílica
- Nanopartícula de óxido de tungstênio
- Nanopartícula de trióxido de molibdênio
- Partícula de Dixoide de Vanádio
- Ta2O5 Nanopartícula
- Nanopartícula de Trióxido de Boro
- Pó de óxidos multimetálicos
- nanopartícula de óxido de alumínio
- Nano pó de terras raras
- Nanopartícula Composta
- Nanofios e Whisker
- Nanotubo de Carbono
- Pó para impressão 3D
- Outros nanomateriais
- Nanopartícula Metálica
- Notícias
- perguntas frequentes
- Enviar consulta
- Contate-nos